Graphit ist neben Diamant und den Fullerenen eine der Modifikationen des Kohlenstoffs. Er kristallisiert hexagonal in dem typischen Schichtengitter, wohingegen Diamant tetraedrisch kristallisiert und Fullerene sich in fünf- oder sechsgliedrigen Ringen zu Kugeln zusammenformen. Das chemische Zeichen der Graphite lautet C.
Struktur und Eigenschaften
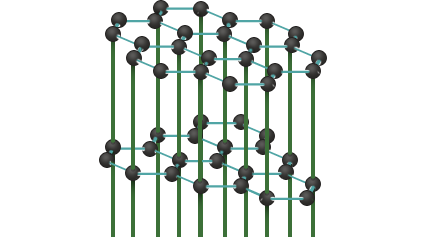
Graphit hat eine Schichtstruktur. In einer Schicht ist jedes Kohlenstoffatom an drei weitere gebunden, sodass sich ein zweidimensionales Netzwerk aus Sechsecken von Kohlenstoffatomen ergibt. Für diese (kovalenten) Bindungen gibt jedes Kohlenstoffatom drei seiner vier Valenzelektronen ab. Die "vierten" Valenzelektronen bauen ein über die ganze Schicht reichendes delokalisiertes (aromatisches) Pi-Elektronensystem auf. Diese Elektronen sind innerhalb der Schicht frei beweglich, sodass Graphit parallel zu den Kohlenstoffschichten elektrisch leitfähig ist.
Jedes Kohlenstoffatom einer Schicht ist mit einem Gegenstück der benachbarten Schicht verbunden. Diese Bindungen sind mit 3,35 Å mehr als doppelt so lang wie die Bindungen innerhalb einer Schicht (1,421 Å). Dadurch sind sie sehr schwach, und Graphit kann parallel zu den Schichten leicht gespalten werden.
Vorkommen - Gewinnung - Verwendung
Synthetischer Graphit (künstlicher Graphit)
Er wird durch Pyrolyse aus Pech- oder Petrolkoksen unter Zugabe von Bindemitteln, vor allem Teer und Pech, gewonnen. Die Formgebung erfolgt durch Pressvorgänge unter hohem Druck zu sogenannten grünen Formkörpern. In einem weiteren Schritt werden diese Formkörper unter Luftausschluss circa vier Wochen lang bei bis zu 1.000 °C zu Hartbrandkohlen gebrannt. In einem letzten Schritt erfolgt die eigentliche Graphitierung durch eine Temperaturbehandlung bei 2.700 °C und darüber. Dieser Vorgang nimmt noch einmal circa zehn bis zwölf Tage in Anspruch.
Die Umwandlung vom amorphen zum graphitierten Zustand erfolgt durch die zugefügte Wärme unter Sauerstoffausschluss. Die hohen Temperaturen bewirken eine weitgehende Ordnung der Kohlenstoff-Schichtebenen im intrakristallinen Bereich.
Die vorrangige Nutzung von künstlichem Graphit sind Graphitelektroden. Es werden weltweit mehrere Millionen Tonnen im Jahr zur Produktion von Elektrostahl verbraucht.
Natürlicher Graphit
Die wichtigsten natürlichen Graphitvorkommen befinden sich in China, Indien, Brasilien, Mexiko und in der Ukraine. Das Mineral wird dort sowohl im Tagebau als auch unter Tage in großen Mengen (circa 500.000 Tonnen pro Jahr) gefördert.
Amorphe Kohlenstoffe
Hierzu gehören Ruße, Holzkohlen, einige Aktivkohlen und nicht kalzinierte Kokse und Anthrazite. Sie sind ähnlich aufgebaut wie der Graphit. Die Schichten sind aber nicht parallel geordnet, sondern regellos gegeneinander verschoben oder verdreht.
Graphitpulver und -granulate
Graphit ist ein feuerfestes Material. Es ist schmierfähig, elektrisch leitfähig, chemisch inert und von schwarzer Färbung. Aufgrund dieser Eigenschaften werden Graphitpulver oder -granulate in vielen Bereichen eingesetzt:
- Schmelztiegelherstellung
- Schmier- und Trennmittel
- Bremsbeläge
- Lacke und Farben
- Katalysatoren
- Batterien
- Folien und Dichtungen
- Aufkohlungsmaterial für Gießereien.
Umwandlungen
Bei Raumtemperatur und Normaldruck ist Graphit die thermodynamisch stabile Modifikation des Kohlenstoffs.
Bei sehr hohem Druck (über 100.000 bar), Katalysatoren und hohen Temperaturen (um 2.400 °C) wandeln sich Graphite schnell in Diamant um, der unter diesen Bedingungen thermodynamisch stabiler ist.
Physikalische Eigenschaften
| Sublimationspunkt | 3.825 °C |
| Dichte bei 20 °C | 2,26 g/cm3 |
| Härte nach Mohs | 0,5 |
| CAS-Nr. | 7440-44-0 |
